Am CBR werden fortgehend Methoden für die synthetische Biotechnologie entwickelt. Mit Ihnen beschreiten wir neue Wege oder verbessern bestehende Prozesse.
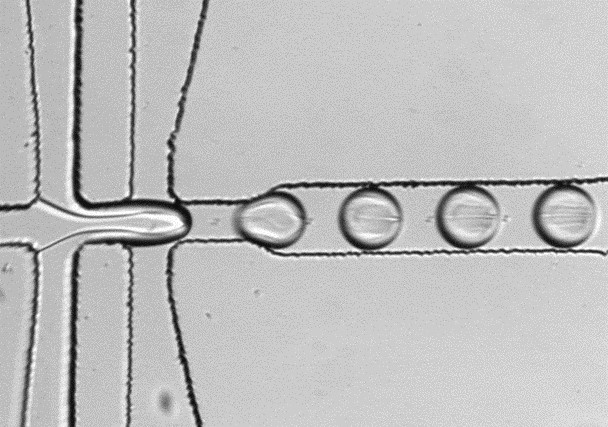
Unser Schwerpunkt liegt auf der Entwicklung biochemischer Assays für die Absorptionsbasierte Ultrahoch-Durchsatz-Droplet-Mikrofluidik. Diese Assays werden beispielsweise in Enzym-Engineering-Experimenten zur Sichtung besonders großer Bibliotheken genutzt. Darüber hinaus kombinieren wir die Droplet-Mikrofluidik mit Methoden der synthetischen Biologie, um neue Enzyme aus Metagenomen im Hochdurchsatz zu identifizieren.
Durch Droplet-Mikrofluidik können biochemische Assays vom üblichen µL-Maßstab in den Pikoliter-Maßstab miniaturisiert werden. Droplets sind monodisperse Tropfen, die mittels mikrofluidischer Chips zu Tausenden pro Sekunde automatisch hergestellt werden können.
Die einzelnen Droplets fungieren als geschlossene Reaktionsräume und können ähnlich wie die einzelnen Wells in Mikrotiterplatten genutzt werden. Mit Detektoren ausgestattete mikrofluidische Chips können beispielsweise Absorptionssignale von Droplets auslesen. Auf Basis dieser Signale können einzelne Droplets in speziellen Sortierungschips, mit einem Durchsatz von bis zu 300 Hz gesichtet und zur weiteren Analyse gezielt isoliert werden.
Dadurch lassen sich Durchsatz und Ressourcenverbrauch im Vergleich zu herkömmlichen Mikrotiterplatten-Assays beträchtlich verbessern.
Biologische Zellfabriken können eine große Auswahl an Produkten wie zum Beispiel Treibstoffe oder Pharmazeutika nachhaltig herstellen. Damit unterstützen sie umweltfreundlichere Industrieprozesse und den notwendigen Wandel in Richtung einer biobasierten Wirtschaft. Die Entwicklung dieser Zellfabriken ist derzeit jedoch zeitaufwändig und arbeitsintensiv, da unter anderem auf die Integrität des verwendeten Organismus geachtet werden muss. Durch die Übertragung der Reaktion aus dem Inneren der Zelle in die freie Lösung können diese Einschränkungen jedoch überwunden werden. Daher stellt die ausreichende Bereitstellung von Proteinen für synthetische Enzymkaskaden (in vitro) ein wichtiges Entwicklungsfeld dar.
Bei der Hefe Pichia pastoris handelt es sich um eines der bedeutendsten heterologen Expressionssysteme der Biotechnologie. Neben der Sekretion von Proteinen aus der Zelle heraus werden auch posttranslationale Modifikationen (PTM) wie beispielsweise die Glykosylierung ermöglicht. Sekretierte Proteine lassen sich anschließend industriell kostengünstiger anwenden. Obwohl P. pastoris für industrielle Anwendungen weit verbreitet und bereits intensiv untersucht worden ist, fehlt eine effiziente Strategie, die es erlaubt, optimale Expressions- und Sekretionsbedingungen systematisch zu identifizieren. Daher wurde am Lehrstuhl für Chemie Biogener Rohstoffe ein modularer Werkzeugkasten aus standardisierten genetischen Elementen und verschiedenen Sekretionssignalen entwickelt (Stichwort Synthetische Biologie). Diese Elemente können unkompliziert mit Hilfe einer hierarchischen Assemblierung zu großen und diversen Bibliotheken zufällig kombiniert werden. Die Identifikation der besten Kombination erfolgt hierbei robotergestützt im Hochdurchsatz-Screening (Link). Mittels des entwickelten Verfahrens konnten neue Kombinationen identifiziert werden, die zu einer gesteigerten Proteinsekretion führten. Das flexible Design der hier bereitgestellten Plattform ermöglicht eine effiziente Optimierung im Hochdurchsatzverfahren und stellt somit eine wertvolle Ressource für zukünftige Entwicklungsvorhaben dar.
Mit dem am Lehrstuhl vorhandenen Knowhow und der Geräteausstattung lassen sich grundsätzlich vielfältige Laborarbeiten automatisiert und in hohem Durchsatz realisieren.
Etablierte Verfahren sind beispielsweise:
- Durchmusterung von Stammsammlungen auf Polysaccharidproduzenten
- Durchmusterung von Enzymbibliotheken bezüglich Aktivität, Stabilität oder Substratspezifität
- Extraktion und Reinigung von Proteinen, RNA und DNA
- absorptive und chromatographische Trennmethoden im 96-Well-Format (z. B. SEC oder IMAC)
- enzymatische und chemische Quantifizierungsmethoden, z. B. für Glucose, Pyruvat, Proteine
- Enzymaktivitätsassays
- Enzymkinetiken
- Optimierungsexperimente, z.B. Mediumsoptimierung