Für den Rohstoffwandel werden umweltfreundliche, effiziente und wirtschaftliche Prozesse auf der Basis neuer Synthesemethoden und -strategien benötigt. Wir widmen uns diesem Forschungsfeld, wobei der Fokus auf enzymatischen Synthesemethoden sowie der Kombination mit chemischen oder elekrochemischen Methoden liegt, genannt Biohybride Katalyse.
Die Natur hält eine Vielfalt von Biokatalysatoren (Enzymen) bereit, die alle intrinsisch die Fähigkeit besitzen biogene Substrate umwandeln zu können. Ansätze für die Umwandlung von Biomasse in Grund- und Feinchemikalien erfordern aber biochemische Parameter, die sich signifikant von denen in den natürlichen Habitaten der Enzyme unterscheiden. Die Enzyme müssen sowohl untereinander kompatibel sein, aber auch alle auftretenden Intermediate, hohe Produktkonzentrationen und Lösungsmittel tolerieren.
Um sie dafür und auf die entsprechenden Biotransformationen zu optimieren, müssen wir viele Enzymeigenschaften, wie (Thermo)Stabilität, spezifische Aktivität, Substratspezifität, Cofaktorspezifität und Inhibition maßschneidern. Dabei steht immer eine Anwendung im Zentrum, wir versuchen aber auch das molekulare Verständnis der Katalyseprozesse im Enzym durch Enzymengineering zu verstehen. Erfolgreiche Beispiele aus unseren Arbeiten sind die Stabilisierung von Enzymen für die Funktion bei hohen Temperaturen, Optimierung der generellen Aktivität, der Änderung der Cofaktorspezifität und die Verwendung von nichtnatürlichen Cofaktoren.
Entscheidend für den Erfolg einer gerichteten Evolution sind die Qualität der Bibliotheken und die Effizienz und Genauigkeit der Durchmusterungsverfahren. Wir entwickeln neue Mutagenese- und Rekombiantionsstrategien als auch chemische, enzymatische oder physikalische Hochdurchsatzassays und Selektionsmethoden. Die Assays werden sowohl im klassischen 96-well Format (medium bis high throughput) auf unserer Roboter-Plattform etabliert, als auch für ultrahigh throughput Anwendungen auf unseren mikrofluidischen Systemen.
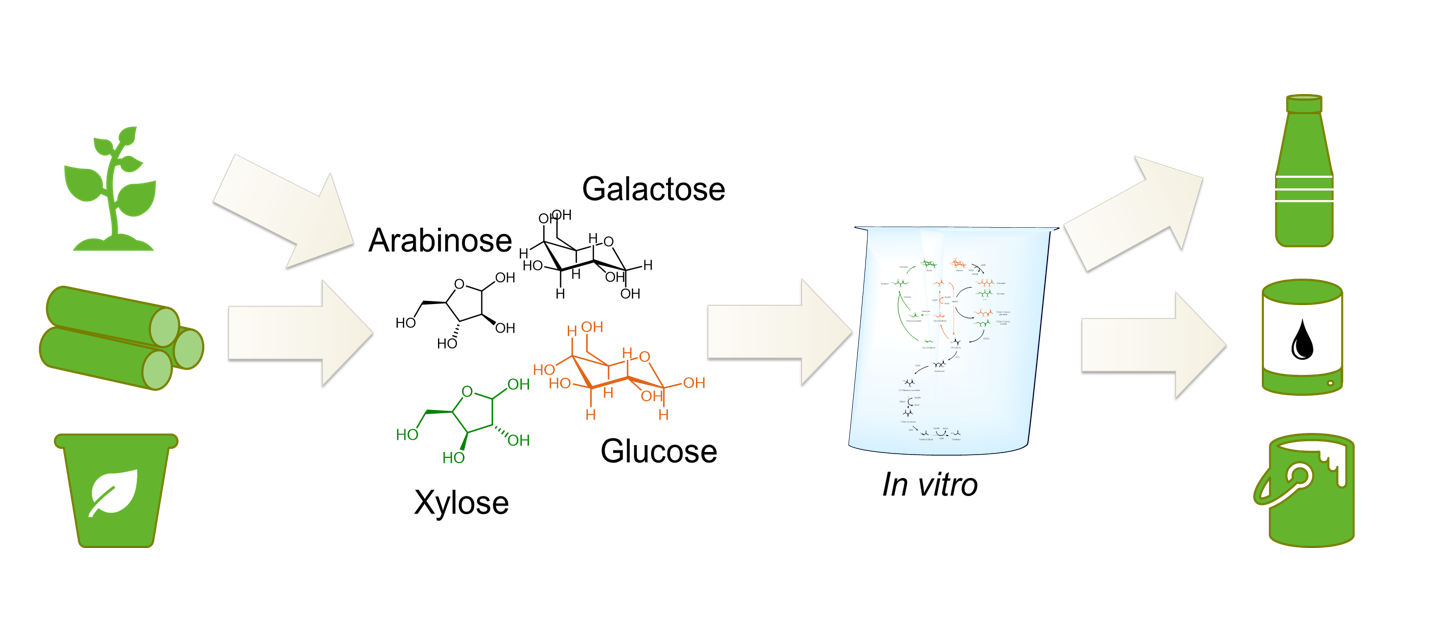
Multi-Enzym-Katalyse bedeutet mehrere Enzyme gleichzeitig zu verwenden, ohne die entstehenden Zwischenstufen aufwendig zu isolieren bevor sie für die nächste Reaktion eingesetzt werden. Dies ist bei Enzymen, im Gegensatz zu chemischen Katalysatoren, besonders dadurch möglich, dass sie unter ähnlichen Bedingungen effektiv arbeiten können oder so verändert werden können, dass sie miteinander kompatibel sind. Unser Ziel ist es, durch Multi-Enzym-Katalyse aus Zuckern oder anderen Molekülen, die aus nachwachsenden Rohstoffen gewonnen werden können, Plattform- und Feinchemikalien herzustellen.
Für die Entwicklung und Optimierung der Multi-Enzym-Katalyse erforschen wir
- Die intrinsischen Eigenschaften der beteiligten Enzyme (Aktivität, Spezifität, Stabilität) und optimieren sie, falls nötig (siehe Enzym Engineering).
- Analytische Methoden wie HPLC, GC, MS, NMR oder enzymatische Assays, zum Nachweis und zur Quantifizierung der Intermediate, Produkte und ggf. Nebenprodukte, um das Zusammenspiel der Enzyme in der Multi-Enzym-Katalyse zu verstehen und ihre Schwächen und Stärken zu identifizieren.
- Mathematische Modelle (in Kooperation), um Vorhersagen über Flaschenhälse und optimale Bedingungen für die Multi-Enzym-Katalyse entsprechend der Fragestellung treffen zu können.
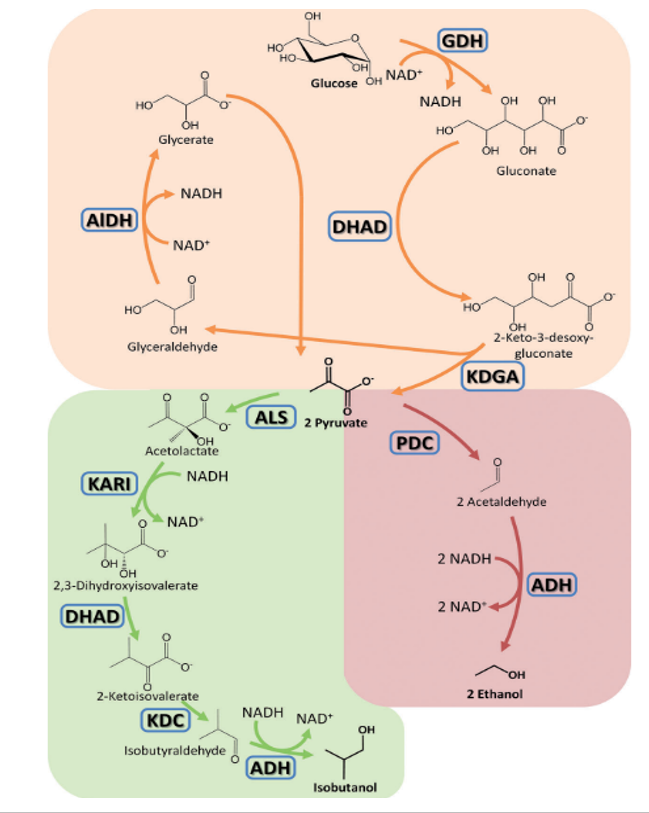
Am Lehrstuhl wurden bereits verschiedene Multi-Enzymkaskaden etabliert und fortlaufend weiterentwickelt (Abb. 2).
In einer von uns entwickelten artifiziellen Enzymkaskade wird aus Glucose mit vier Enzymen Pyruvat hergestellt und die klassische Glykolyse, die dafür 10 Enzyme benötigt stark verkürzt und vereinfacht. Pyruvat wiederum kann als Startmolekül für eine Reihe interessanter Produkte mit jeweils eigenen Kaskaden hergestellt werden link Aminosäure, Isobutanol etc.).
Andere Startmoleküle für unsere Multi-Enzymkatalysen sind Xylose, die aus Hemicellulose gewonnen werden kann oder Glycerol.
Im Rahmen der Multi-Enzym-Katalyse beschäftigen wir uns auch mit der Kopplung von enzymatischen mit chemischen- oder eletrochemischen Reaktionen, dem Design neuer stabilerer oder kostengünstigerer Cofaktoren und notwendiger Weise auch mit Enzym Engineering.
Das neue Feld der Biohybriden Enzymkatalyse hat sich zum Ziel gesetzt, katalytische Methoden aus verschiedenartigen Bereichen mit der Enzymkatalyse zu kombinieren. Unser Hauptaugenmerk richtet sich hierbei auf die Chemo-enzymatische Synthese und biohybride Elektrokatalyse zur Generierung von Grund- und Feinchemikalien aus nachwachsenden Rohstoffen.
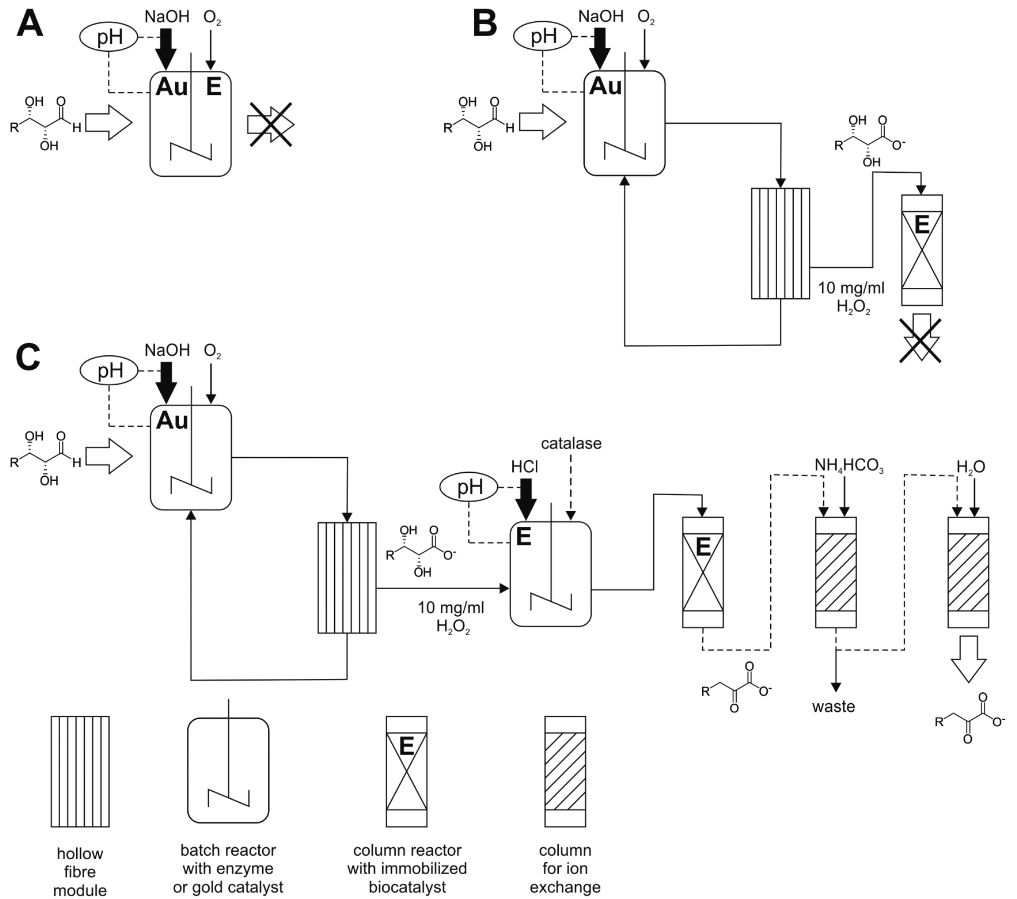
Es gibt bereits eine Reihe von Beispielen, in denen solche biohybriden Ansätze erforscht werden. Es existieren eine Fülle an organischen und anorganisch-chemischen Katalysatoren sowie elektrochemisch genutzten Elektrodenmaterialien. Dennoch fehlt ihnen im Allgemeinen die Kompatibilität mit Enzymen und biogenen Substraten und den dazugehörigen Lösungsmitteln. Auf dieser Basis erforschen wir chemo-enzymatische und elektro-enzymatische Prozesse für die effiziente und zielgerichtete Umsetzung von komplexen biogenen Rohstoffen. Erste Erfolge konnten wir bei der Kombination von chemischer Oxidation durch molekularen Sauerstoff mit biokatalytischen Dehydratisierungsreaktionen verzeichnen. Als Beispiel konnten vier verschiedene 2-Keto-3-desoxy Zuckersäuren durch die Kombinationen eines Goldkatalysators, der in einem kontinuierlichen Reaktor zurückgehalten wurde, mit einer immobilisierten Dehydratase erhalten werden. Des Weiteren wird bei uns die kontinuierliche Verbindung von elektrochemischen Reaktionen mit bioenzymatischer Produktgenerierung durch Prozessanalysen und Elektrodenentwicklung vertiefend erforscht.
Unter Metabolic Engineering versteht man eine Vielzahl unterschiedlicher Methoden, um die Herstellung von wertvollen Zielmolekülen aus billigen und einfachen Substraten mittels mikrobieller Produktionsorganismen zu optimieren, indem die genetischen Informationen der Mikroorganismen verändert oder umsortiert werden. Hierbei werden vor allem metabolische Flüsse verbessert, indem z.B. die Produktion unerwünschter Nebenprodukte verhindert wird oder kritische Flaschenhalsschritte entlang einer enzymatischen Kaskade optimiert werden. Zusätzlich etablieren wir auch neue, künstliche Produktionswege in unseren mikrobiellen Fabriken, um komplett neue Produkte, wie z.B. Feinchemikalien fermentativ herstellen zu können.
Unsere Forschung richtet sich nicht nur auf die Optimierung von konventionellen Labororganismen, sondern auch alternative Produktionsplattformen wie etwa Paenibacillus polymyxa, die interessante Produkte produzieren können. Wir benutzen hocheffiziente, moderne Werkzeuge wie etwa CRISPR/Cas9 um das Genom dieser Organismen gezielt zu verändern und die Produktion zu verbessern. Zusätzlich entwickeln wir auch neue Werkzeuge um komplexe, metabolische Kaskaden zu regulieren.
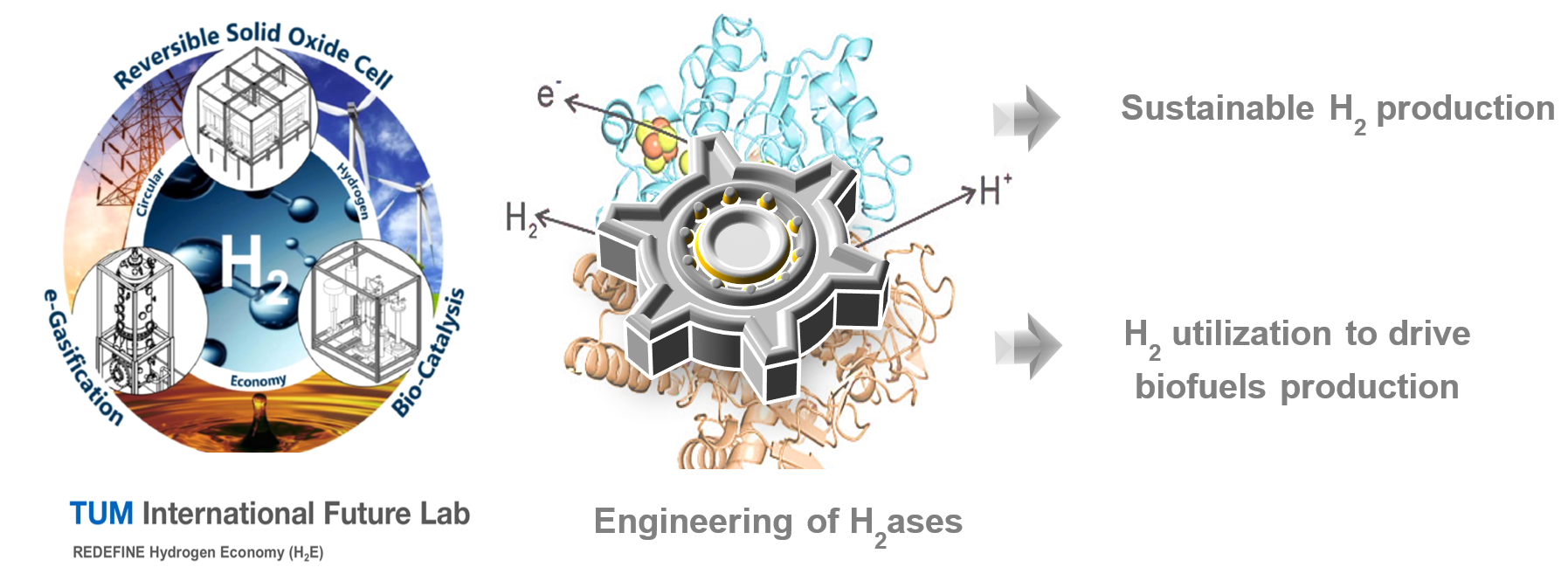
Die Verwendung von grünem Wasserstoff als günstige, saubere Energiequelle als Alternative zu kohlenstoffhaltigen Brennstoffen verringert die Kohlendioxidemissionen und trägt zur Eindämmung der globalen Erwärmung bei. Hydrogenasen sind attraktive Biokatalysatoren für die Produktion und Nutzung von Wasserstoff. Im Rahmen des TUM international Future Lab (REDEFINE H2) beabsichtigen wir mit Hilfe von Hydrogenasen grünen Wasserstoff aus biogenen Materialien wie Zuckern herzustellen. Darüber hinaus arbeiten wir an der Entwicklung besserer Hydrogenase-Varianten, die in industriellen Prozessen eingesetzt werden können, wo Wasserstoff als Antrieb für die Synthese von Biokraftstoffen genutzt werden kann.